Panoramica sulla geochimica del boro (B)
Il boro ha due isotopi stabili (10B, 11B) e 13 isotopi radioattivi (da 7B a 21B, escluse le forme stabili). Gli isotopi stabili del boro sono gli unici presenti in natura: il 10B costituisce il 20% del boro naturale e l 11B l’80%.
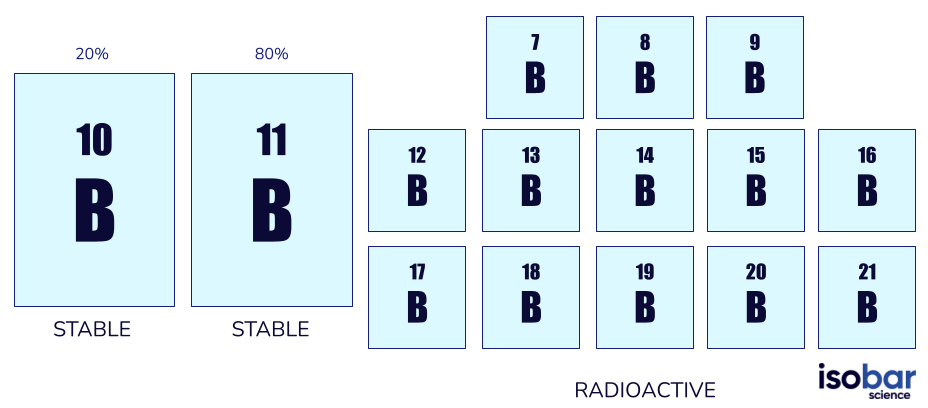
I due isotopi del boro solitamente usati negli studi geochimici (a sinistra) e gli altri 13 isotopi radioattivi del boro (a destra)
Diversi materiali geologici e condizioni ambientali sono caratterizzati da differenti intervalli di rapporti isotopici del boro. Per questo motivo, questo valore è ampiamente utilizzato per il fingerprinting geochimico, il tracciamento delle fonti, la previsione delle contaminazioni e lo studio dei cicli globali del carbonio e della circolazione oceanica.
Ulteriori informazioni sui tipi di materiale e la selezione dei campioni per l’analisi del boro.
Avviso: questo video è ospitato su un sito esterno e potrebbe contenere pubblicità.
Questo video è un estratto del webinar di Beta Analytic Boron Isotopic Analysis
Paleoclimatologia e paleoceanografia
Il boro disciolto nell’acqua di mare si trova principalmente sotto forma di due specie mononucleari, l’acido borico (H3BO3 o B(OH)3) e il borato (BO3-3 o B(OH)4−). Le due specie subiscono un frazionamento isotopico diverso e l’acido borico ha un contenuto dell’isotopo più pesante (11B) superiore del 27,2% rispetto al borato. La proporzione relativa tra queste specie dipende dal pH, come descritto di seguito:
B(OH)3 + H2O ↔ B(OH)4− + H+
pH alto ↔ pH basso
Il boro viene incorporato nei carbonati biogenici e inorganici principalmente sotto forma di borato. Tuttavia, la specie e la concentrazione del boro incorporato nei carbonati biogenici (ad es. le conchiglie) dipendono dal pH. La composizione isotopica del boro nei carbonati biogenici marini è quindi correlata al pH dell’acqua di mare.
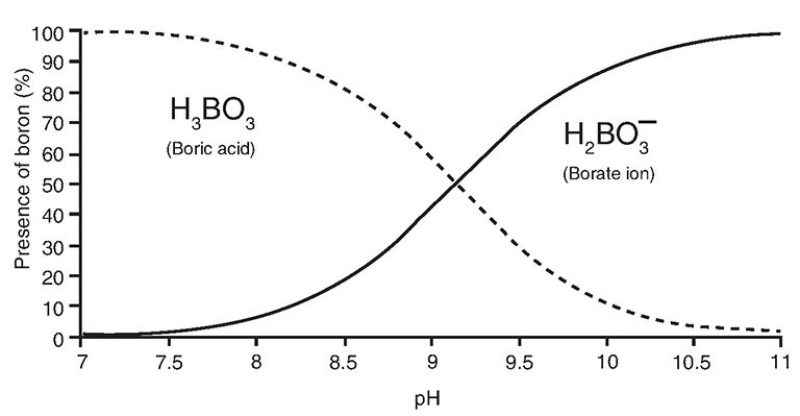
Relazione tra il pH e l’abbondanza di due diversi isotopi del boro (https://jpt.spe.org/comparison-methods-boron-removal-flowback-and-produced-waters)
Risorse correlate sul nostro blog:
Fingerprinting geochimico e tracciamento delle fonti degli inquinanti
Il boro è ampiamente usato nell’industria (lubrificanti, flussanti, additivi), nell’agricoltura (micronutriente nei fertilizzanti) e nei prodotti per la casa (agente sbiancante). Il boro è un additivo importante nella fabbricazione dell’acciaio e viene usato per aumentare la temprabilità dei materiali. Per esempio, gli acciai al boro trovano applicazione nell’industria nucleare per la schermatura e il controllo delle reazioni nucleari, grazie alla capacità naturale di questo elemento di assorbire i neutroni. In altri settori, un composto del boro noto come borato di sodio o borace viene ampiamente utilizzato nei detergenti, per rimuovere le macchie e la muffa, e nei prodotti cosmetici come conservante e agente tampone.
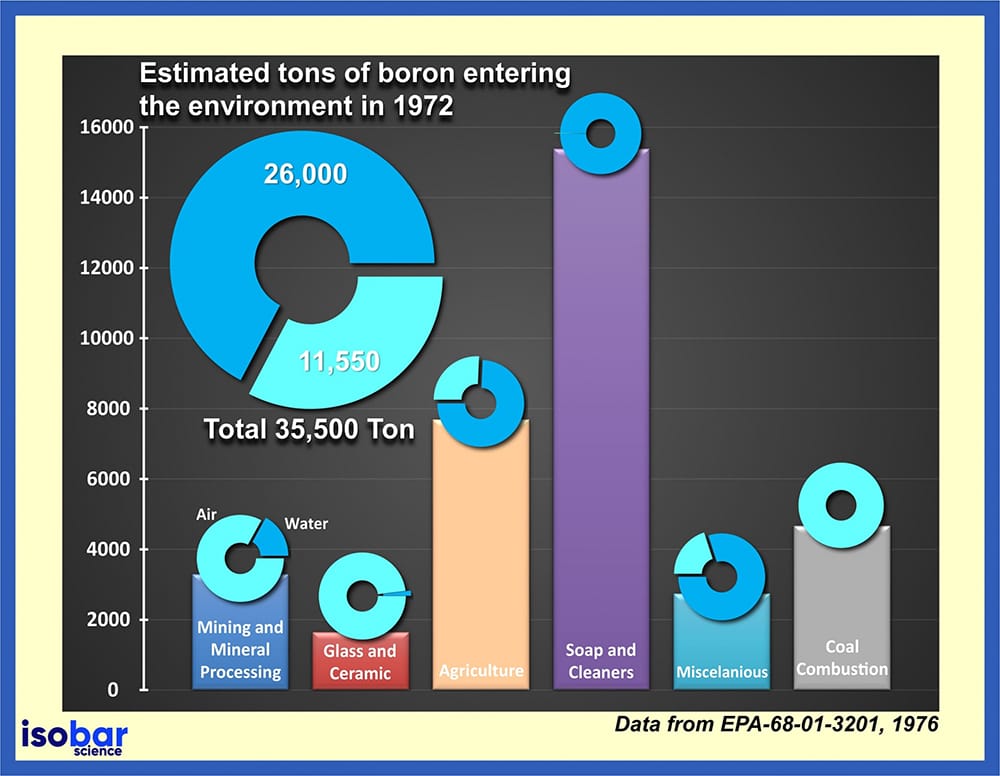
Stima delle tonnellate di boro scaricato nell’ambiente dal 1972 (dati da EPA-68-01-3201,1976).
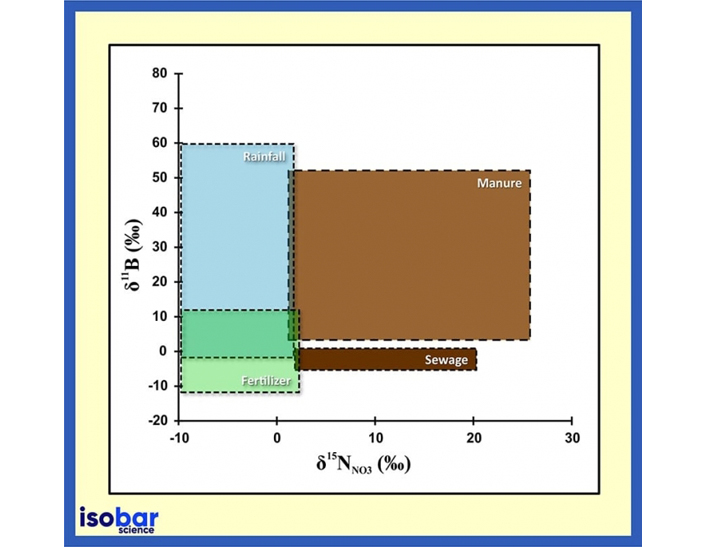
Firma isotopica e origine di boro e azoto in acqua (Briand et al., 2013).
L’ampio uso del boro in molti prodotti diversi determina un rilascio continuo di questo elemento nell’ambiente. Secondo i dati della US Environmental Protection Agency (EPA, 1976), solo nel 1972, sono state scaricate nell’ambiente 35,5 migliaia di tonnellate di boro, di cui il 73% direttamente in acqua. Questa contaminazione è particolarmente problematica perché il boro non può essere distrutto nell’ambiente, ma può solo cambiare forma separandosi e legandosi ad altre particelle nel suolo, nei sedimenti e nell’acqua. Può infine essere incorporato negli alimenti (frutta e verdura), dato che è un nutriente essenziale per la crescita delle piante.
Riferimenti
Briand, C., Plagnes, V., Sebilo, M., Louvat, P., Chesnot, T., Schneider, M., Ribstein, P. and Marchet, P., (2013). Combination of nitrate (N, O) and boron isotopic ratios with microbiological indicators for the determination of nitrate sources in karstic groundwater. Environmental Chemistry, 10(5), pp.365-369. DOI: 10.1071/EN13036
Chalk, T.B., Foster, G.L. and Wilson, P.A., (2019). Dynamic storage of glacial CO2 in the Atlantic Ocean revealed by boron [CO32−] and pH records. Earth and Planetary Science Letters, 510, pp.1-11. DOI: 10.1016/j.epsl.2018.12.022
EPA (Environmental Protection Agency), (1976). Chemical technology and economics in environmental perspectives. Task II- Removal of Boron from wastewater. Environmental Protection Agency, Office of Toxic Substances, Washington, D.C. 20460
Giri, S.J., Swart, P.K. and Pourmand, A., (2019). The influence of seawater calcium ions on coral calcification mechanisms: Constraints from boron and carbon isotopes and B/Ca ratios in Pocillopora damicornis. Earth and Planetary Science Letters, 519, pp.130-140. DOI: 10.1016/j.epsl.2019.05.008
Martínez-Botí, M.A., et al. (2015). Boron isotope evidence for oceanic carbon dioxide leakage during the last deglaciation. Nature, 518(7538), pp.219-222. DOI: 10.1038/nature14155

