Aperçu de la géochimie du bore (B)
Le bore a deux formes d’isotopes stables (10B, 11B) ainsi que 13 formes d’isotopes radioactifs (de 7B à 21B, sans compter les formes stables). Les formes stables du bore sont les seuls isotopes naturels avec 10B représentant 20 % de bore naturel et 11B représentant 80%.
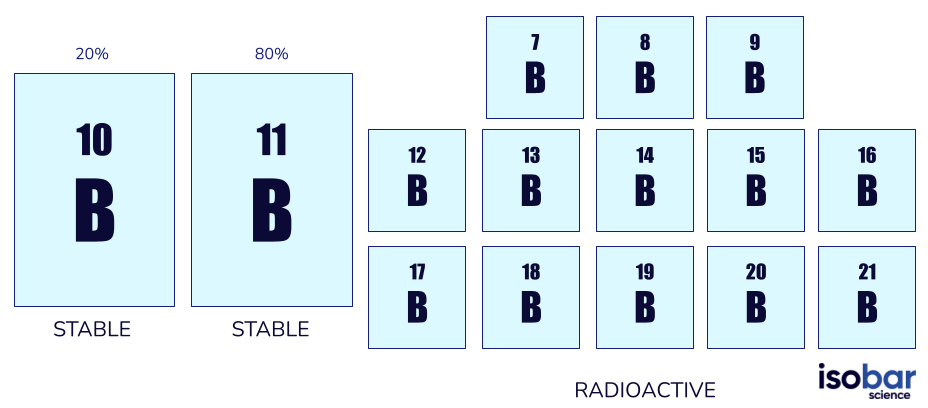
Voici les deux espèces d’isotopes de bore couramment utilisées dans les études géochimiques (à gauche) et les 13 autres espèces d’isotopes de bore radioactifs (à droite)
Les différents matériaux du système terrestre et les conditions environnementales sont caractérisés par des plages discrètes pour le rapport isotopique du bore. Ainsi, ce paramètre est largement utilisé dans les empreintes géochimiques, le suivi des sources, la prévision de la contamination, les cycles mondiaux du carbone et les études sur la circulation océanique.
Plus d’informations sur les types d’échantillons et leur sélection pour l’analyse du bore
Avis de non-responsabilité : cette vidéo est hébergée sur un site tiers et peut contenir de la publicité.
Cet extrait vidéo fait partie du webinaire de Beta Analytic : Analyse isotopique du bore
Paléoclimatologie & Paléocéanographie
Le bore dissous dans l’eau de mer apparaît principalement sous la forme de deux espèces mononucléées, l’acide borique (H3BO3 ou B(OH)3) et borate (BO3-3 ou B(OH)4−), avec un fractionnement isotopique distinct entre les deux espèces tel que l’acide borique est enrichi en isotope le plus lourd (11B) de 27,2%. La proportion relative de ces espèces dépend du pH, comme indiqué ci-dessous :
B(OH)3 + H2O ↔ B(OH)4− + H+
pH élevé ↔ pH faible
Le bore est incorporé dans les carbonates biogéniques et inorganiques principalement sous forme d’espèce de borate. Cependant, l’espèce particulière et la concentration de bore incorporé dans les carbonates biogéniques (par exemple les coquilles) dépendent du pH. Ainsi, la composition isotopique du bore des carbonates biogéniques marins reflète le pH de l’eau de mer.
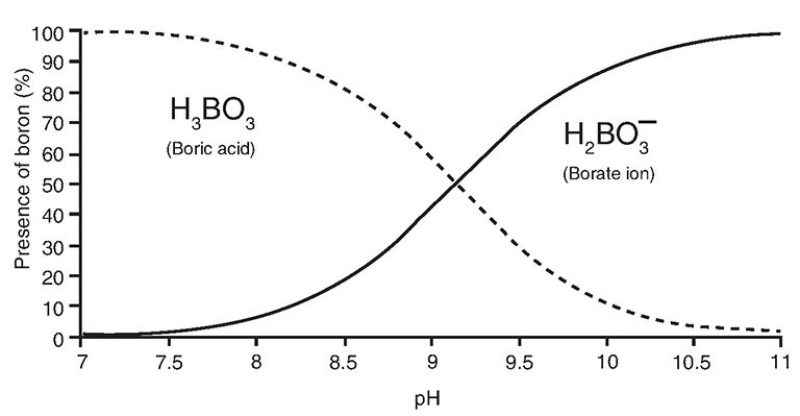
La relation entre le pH et le pourcentage de deux espèces de bore différentes (https://jpt.spe.org/comparison-methods-boron-removal-flowback-and-produced-waters)
En savoir plus sur nos articles de blog :
Empreinte géochimique et suivi des sources de contaminants
Le bore est largement utilisé dans l’industrie (lubrifiant, fondant, additif), l’agriculture (micronutriment dans les engrais) et les ménages (agent de blanchiment). Le bore est un additif important dans la fabrication de l’acier pour augmenter la trempabilité d’un matériau. Par exemple, les aciers au bore sont largement utilisés dans l’industrie nucléaire pour protéger les systèmes et contrôler les réactions nucléaires étant donné leur capacité naturelle à absorber les neutrons. Dans d’autres industries, un composé de bore connu sous le nom de borate de sodium (« Borax ») est largement utilisé dans les détergents pour éliminer les taches et la moisissure, ainsi que dans les produits cosmétiques en tant qu’agent conservateur et tampon.
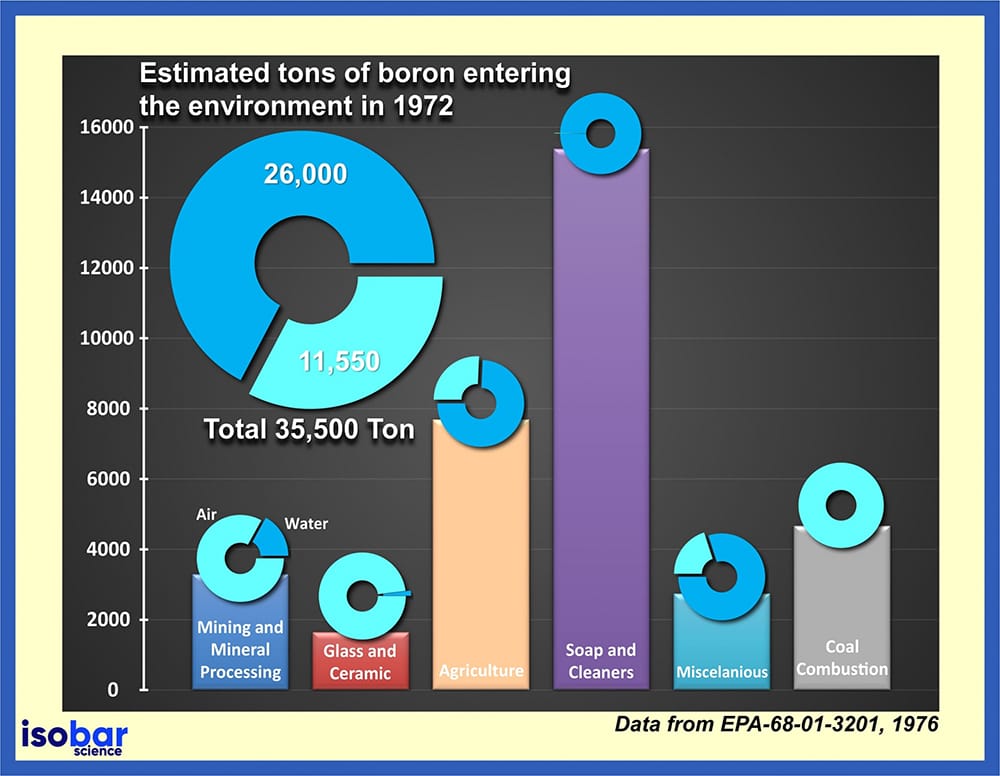
Estimation des tonnes de bore entrant dans l’environnement depuis 1972 (Données de EPA-68-01-3201, 1976).
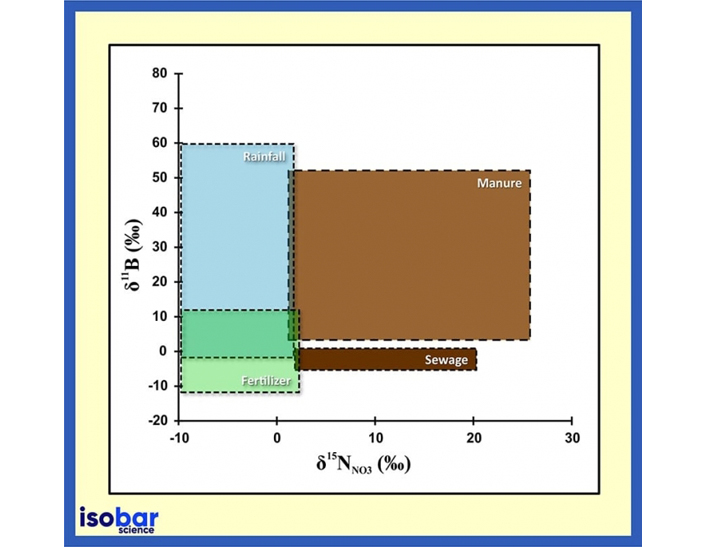
Signature de la source des rapports isotopiques du bore et de l’azote dans l’eau (Briand et al., 2013).
Compte tenu de l’utilisation intensive du bore dans de nombreux produits, il est régulièrement rejeté dans l’environnement. D’après les données fournies par l’Agence américaine de protection de l’environnement (Environmental Protection Agency, EPA, 1976), en 1972 seulement, un total de 35,5 kilotonnes de bore a été rejeté dans l’environnement, dont 73 % ont été directement introduits dans l’eau. La libération de bore est particulièrement problématique car le bore ne peut pas être détruit dans l’environnement, mais il peut changer de forme en se séparant et en se fixant à d’autres particules dans les sols, les sédiments et l’eau. Ce bore peut éventuellement se retrouver dans les aliments (fruits et légumes) étant donné qu’il est un nutriment essentiel à la croissance des plantes.
Références
Briand, C., Plagnes, V., Sebilo, M., Louvat, P., Chesnot, T., Schneider, M., Ribstein, P. and Marchet, P., (2013). Combination of nitrate (N, O) and boron isotopic ratios with microbiological indicators for the determination of nitrate sources in karstic groundwater. Environmental Chemistry, 10(5), pp.365-369. DOI: 10.1071/EN13036
Chalk, T.B., Foster, G.L. and Wilson, P.A., (2019). Dynamic storage of glacial CO2 in the Atlantic Ocean revealed by boron [CO32−] and pH records. Earth and Planetary Science Letters, 510, pp.1-11. DOI: 10.1016/j.epsl.2018.12.022
EPA (Environmental Protection Agency), (1976). Chemical technology and economics in environmental perspectives. Task II- Removal of Boron from wastewater. Environmental Protection Agency, Office of Toxic Substances, Washington, D.C. 20460
Giri, S.J., Swart, P.K. and Pourmand, A., (2019). The influence of seawater calcium ions on coral calcification mechanisms: Constraints from boron and carbon isotopes and B/Ca ratios in Pocillopora damicornis. Earth and Planetary Science Letters, 519, pp.130-140. DOI: 10.1016/j.epsl.2019.05.008
Martínez-Botí, M.A., et al. (2015). Boron isotope evidence for oceanic carbon dioxide leakage during the last deglaciation. Nature, 518(7538), pp.219-222. DOI: 10.1038/nature14155

