Bor (B) Überblick über die Geochemie.
Bor hat zwei Formen stabiler Isotope (10B, 11B) sowie 13 Formen radioaktiver Isotope (von 7B bis 21B, ohne die stabilen Formen). Stabile Formen von Bor sind die einzigen natürlich vorkommenden Isotope, wobei 10B 20% des natürlichen Bors und 11B 80% ausmacht.
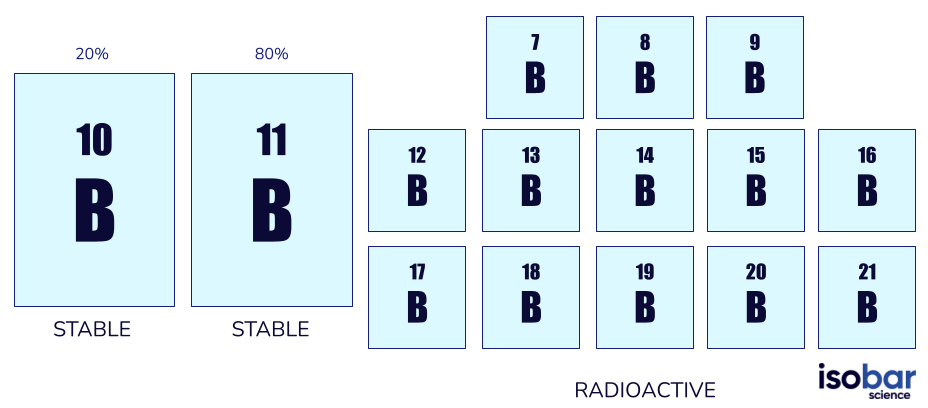
Die beiden Bor-Isotopenarten, die üblicherweise in geochemischen Untersuchungen verwendet werden (links) und die weiteren 13 radioaktiven Bor-Isotopenarten (rechts)
Unterschiedliche Erdsystemmaterialien und Umweltbedingungen sind durch diskrete Bereiche für das Bor-Isotopenverhältnis gekennzeichnet. Daher wird dieser Parameter ausgiebig bei geochemischen Fingerabdrücken, Quellenverfolgung, Kontaminationsvorhersage, globalen Kohlenstoffkreisläufen und Ozeanzirkulationsstudien verwendet.
Weitere Informationen zu Probenarten und -auswahl für die Bor-Analyse
Haftungsausschluss: Dieses Video wird auf einer Website eines Drittanbieters gehostet und kann Werbung enthalten.
Dieser Videoausschnitt ist Teil des Webinars von Beta Analytic: Boron Isotopic Analysis
Paläoklimatologie & Paläozeanographie
Gelöstes Bor im Meerwasser tritt hauptsächlich in Form von zwei einkernigen Spezies auf, Borsäure (H3BO3 oder B(OH)3) und Borat (BO3-3 oder B(OH)4−), mit einer deutlichen Isotopen-Fraktionierung zwischen den beiden Spezies, wie sodass Borsäure im schwereren Isotop (11B) um 27,2 % angereichert ist. Der relative Anteil dieser Spezies ist pH-abhängig, wie unten gezeigt:
B(OH)3 + H2O ↔ B(OH)4− + H+
Hoher pH-Wert ↔ Niedriger pH-Wert
Bor wird hauptsächlich als Boratspezies in biogene und anorganische Karbonate eingebaut. Allerdings ist die jeweilige Art und Konzentration des in biogenen Karbonaten (z. B. Muscheln) eingebauten Bors pH-abhängig. Somit spiegelt die Bor-Isotopen-Zusammensetzung von marinen biogenen Karbonaten den pH-Wert des Meerwassers wider.
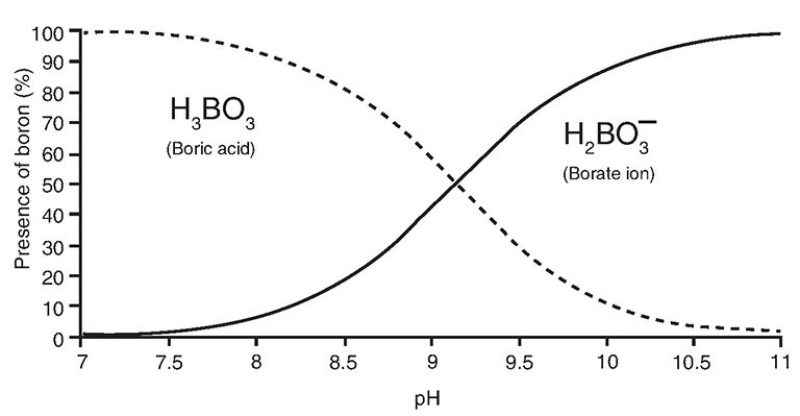
Die Beziehung zwischen pH und dem Prozentsatz von zwei verschiedenen Borarten (https://jpt.spe.org/comparison-methods-boron-removal-flowback-and-produced-waters)
Lesen Sie mehr in unseren Blogbeiträgen:
Geochemischer Fingerabdruck und Schadstoffquellenverfolgung
Bor wird in großem Umfang in der Industrie (Schmiermittel, Flussmittel, Zusatzstoffe), in der Landwirtschaft (Mikronährstoff in Düngemitteln) und in Haushalten (Bleichmittel) verwendet. Bor ist ein wichtiger Zusatzstoff in der Stahlherstellung, um die Härte eines Materials zu erhöhen. Beispielsweise werden Borstähle in der Nuklearindustrie aufgrund ihrer natürlichen Fähigkeit, Neutronen zu absorbieren, häufig zur Abschirmung von Systemen und zur Steuerung von Kernreaktionen verwendet. In anderen Branchen wird eine als Natriumborat („Borax“) bekannte Borverbindung in großem Umfang für Waschmittel zur Entfernung von Flecken und Schimmel, sowie in kosmetischen Produkten als Konservierungs- und Puffermittel verwendet.
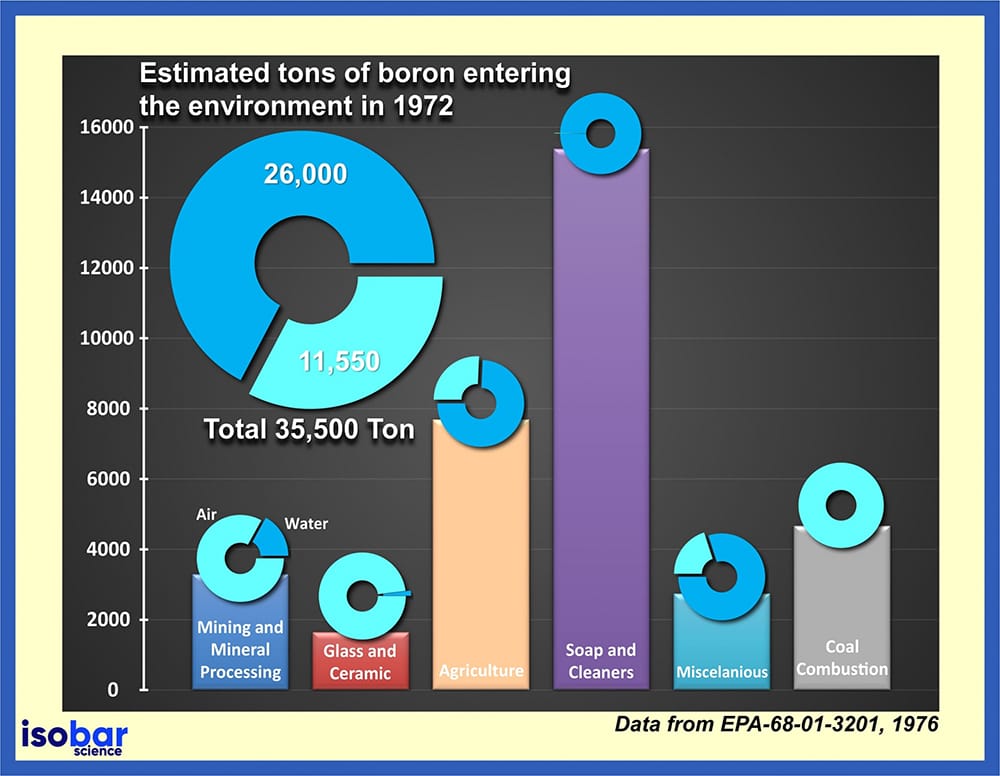
Geschätzte Tonnen von Bor, die seit 1972 in die Umwelt gelangt sind (Daten von EPA-68-01-3201, 1976).
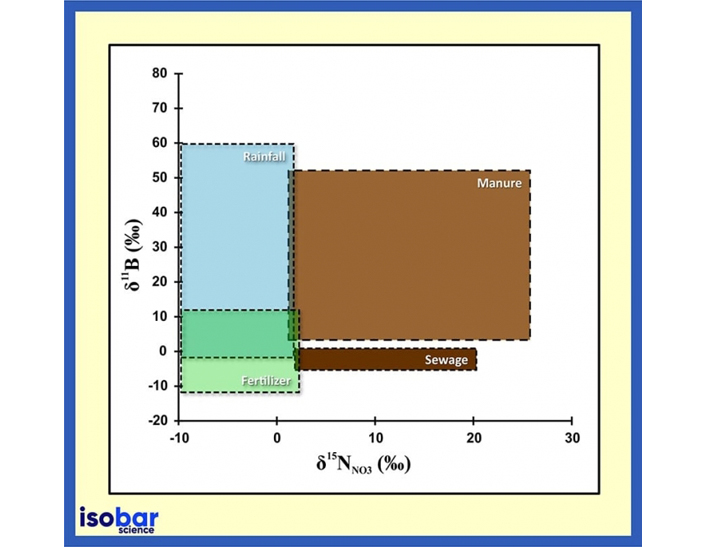
Quellensignatur der Isotopenverhältnisse von Bor und Stickstoff in Wasser (Briand et al., 2013).
Aufgrund der umfangreichen Verwendung von Bor in vielen verschiedenen Produkten wird es regelmäßig in die Umwelt freigesetzt. Basierend auf Daten der US Environmental Protection Agency (EPA, 1976) wurden allein im Jahr 1972 insgesamt 35,5 Kilotonnen Bor in die Umwelt freigesetzt, wovon 73 % direkt ins Wasser gelangten. Die Freisetzung von Bor ist besonders problematisch, da Bor in der Umwelt nicht zerstört werden kann, sondern seine Form ändern kann, indem es sich von anderen Partikeln in Böden, Sedimenten und Wasser trennt und anlagert. Dieses Bor kann schließlich seinen Weg in Lebensmittel (Gemüse und Obst) finden, da es ein essentieller Nährstoff für das Pflanzenwachstum ist.
Verweise
Briand, C., Plagnes, V., Sebilo, M., Louvat, P., Chesnot, T., Schneider, M., Ribstein, P. and Marchet, P., (2013). Combination of nitrate (N, O) and boron isotopic ratios with microbiological indicators for the determination of nitrate sources in karstic groundwater. Environmental Chemistry, 10(5), pp.365-369. DOI: 10.1071/EN13036
Chalk, T.B., Foster, G.L. and Wilson, P.A., (2019). Dynamic storage of glacial CO2 in the Atlantic Ocean revealed by boron [CO32−] and pH records. Earth and Planetary Science Letters, 510, pp.1-11. DOI: 10.1016/j.epsl.2018.12.022
EPA (Environmental Protection Agency), (1976). Chemical technology and economics in environmental perspectives. Task II- Removal of Boron from wastewater. Environmental Protection Agency, Office of Toxic Substances, Washington, D.C. 20460
Giri, S.J., Swart, P.K. and Pourmand, A., (2019). The influence of seawater calcium ions on coral calcification mechanisms: Constraints from boron and carbon isotopes and B/Ca ratios in Pocillopora damicornis. Earth and Planetary Science Letters, 519, pp.130-140. DOI: 10.1016/j.epsl.2019.05.008
Martínez-Botí, M.A., et al. (2015). Boron isotope evidence for oceanic carbon dioxide leakage during the last deglaciation. Nature, 518(7538), pp.219-222. DOI: 10.1038/nature14155

